La vacuna argentina contra el COVID fue destacada por la revista Nature y se consolida de cara al mundo
Desde sus inicios, el desarrollo de la vacuna bivalente 100% argentina Arvac Cecilia Grierson contra el COVID-19 marcó un hito disruptivo y exitoso dentro de la ciencia nacional. Se trata de un inoculante contra el virus que paralizó al mundo hecho íntegramente en nuestro país gracias a la alianza de las mentes brillantes del sistema científico público y privado.
Ahora, Infobae accedió en exclusiva a la publicación de un nuevo reconocimiento internacional -nada más y nada menos que un estudio publicado en la prestigiosa revista Nature, un faro de validación para la comunidad científica global- que muestra la importancia de una vacuna made in Argentina que ya es una patente nacional.
Arvac Cecilia Grierson, una vacuna proteica bivalente diseñada para ser usada como refuerzo en mayores de 18 años, es un producto innovador de la ciencia argentina que se venderá al mundo y generará regalías para la economía de nuestro país.
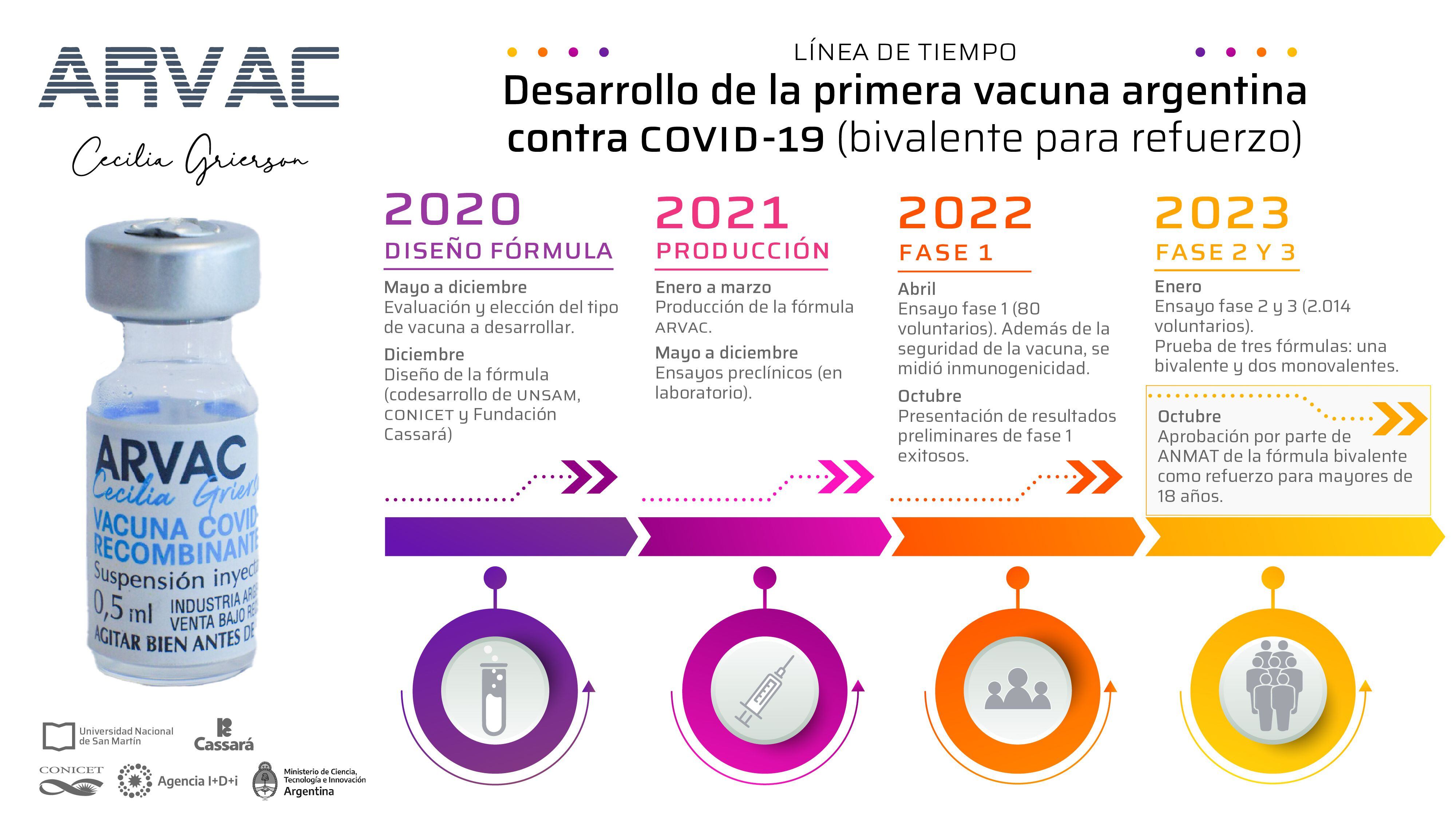
La investigación y el desarrollo del inoculante, aprobado por la ANMAT en octubre de 2023, es fruto del trabajo conjunto de científicos del CONICET, la Universidad Nacional de San Martín (UNSAM) y el Laboratorio Cassará, con apoyo de los entonces ministerios de Salud y de Ciencia, Tecnología a Innovación (MinCyT), junto a la Agencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación (Agencia I+D+i), sumados al esfuerzo conjunto de más de 20 instituciones públicas y privadas.

En la era Milei, esto aún cobra más relevancia: los argentinos ya tenemos entre nosotros un desarrollo que consolida la potencia vigorosa de nuestro sistema científico y el camino exitoso de la sinergia del sector público-privado.
A más de tres meses de su aprobación por la agencia reguladora nacional, aún falta que el Gobierno Nacional, a través de la ANMAT, apruebe el primer lote de dosis bivalentes producido por la planta del Laboratorio Cassará en la Ciudad de Buenos Aires. Confirmado ese paso, las dosis se podrán distribuir en farmacias y centros vacunatorios de todo el país.
ARVAC integra las llamadas vacunas de segunda generación o dosis de refuerzo destinadas a personas ya inmunizadas porque aparece en una etapa en la que la mayoría de las personas han recibido una o dos dosis contra el COVID-19.
El estudio publicado en Nature

En diálogo con Infobae, Juliana Cassataro, la bióloga y doctora en Inmunología que lideró el equipo UNSAM-CONICET que desarrolló la vacuna, se refirió al estudio de flamante publicación: “Esta versión bivalente, que es la primera que va a salir de ARVAC, muestra que los antígenos de la variante Gamma del COVID-19 brindan una excelente respuesta inmune y que, al incluir esa versión y no incluir la ancestral, no emerge el problema del imprinting inmunológico, que se produce cuando el organismo sigue respondiendo a la cepa de coronavirus original a la que fue expuesto por primera vez”.
La revista Nature, que ya había publicado los primeros ensayos de Fase I de ARVAC en humanos y que Infobae había anticipado, presentó ahora la etapa previa e inicial del desarrollo: el ensayo preclínico mediante el cual las investigadoras de la UNSAM y del CONICET eligieron el antígeno Gamma para inducir la respuesta inmune contra SARS-CoV-2.
El nuevo paper reveló las razones detrás de la elección de la variante Gamma del virus SARS-CoV-2 para el desarrollo de la vacuna y destacó la evidencia respaldada por el equipo liderado por Cassataro, investigadora del CONICET en la Escuela de Bio y Nanotecnologías de la UNSAM.
El artículo publicado en Nature da a conocer a la comunidad científica internacional el minucioso proceso de construcción que garantiza la seguridad e inmunogenicidad de la vacuna argentina ARVAC.
La clave reside en la selección de la plataforma vacunal, es decir, la tecnología empleada, que en este caso se basa en la proteína recombinante. Sin embargo, más allá de la tecnología, el desafío radicó en la elección de la proteína que estimularía la respuesta del sistema inmunológico.
Para superar este obstáculo, el equipo de científicos argentinos llevó a cabo ensayos preclínicos in vitro e in vivo, lo que permitió identificar un primer prototipo de vacuna seguro y con capacidad para generar una respuesta inmunológica.
Los resultados sobresalientes de este prototipo facilitaron la obtención de financiamiento para las fases subsiguientes, y el laboratorio Cassará, con capacidad de producción de la vacuna, expresó su interés en asociarse al desarrollo del proyecto.
La primera autora del artículo, Lorena Coria, también investigadora del CONICET en la UNSAM explicó a Infobae que, “una vez que decidimos desarrollar la vacuna a partir de la tecnología de proteína recombinante el desafío fue elegir qué proteína y cuál variante del virus utilizar”.
“Podíamos por ejemplo utilizar fragmentos purificados del virus en su variante ancestral, que era la de Wuhan, o pedacitos de la variante que más circulaba en ese momento que era la Gamma. Hicimos ensayos para elegir el pedacito que más respuesta inmunogénica generaba, es decir, la que inducía mayor título de anticuerpos neutralizantes. Y lo que encontramos es que el prototipo con Gamma se desempeñaba mejor”, completó Coria.
Los detalles de la vacuna ARVAC
La vacuna 100% argentina contra el COVID, se basa en la tecnología de proteína recombinante, una tecnología muy segura y conocida que se utiliza desde hace tres décadas para fabricar la vacuna contra la Hepatitis B, que se utiliza en niños recién nacidos, o contra el HPV, que se aplica a adolescentes.
Una de sus grandes ventajas es que se puede almacenar y transportar refrigerada (2 – 8 °C), lo que representa una gran ventaja en términos logísticos respecto a las vacunas alternativas en base a ARN mensajero que requieren almacenarse congeladas a -70°C.
“ARVAC no posee el antígeno versión ancestral por lo cual no tiene el problema del imprinting inmunológico que las vacunas bivalentes de ARN poseen. Además, fue diseñada para que su principio activo pueda actualizarse en cuatro meses para hacer frente a nuevas variantes del virus que escapen a la respuesta inmunológica de la población. Al ser producida en el país garantiza la respuesta más veloz frente a una nueva emergencia”, explicaron desde la UNSAM en un comunicado.
Los ensayos preclínicos publicados en Nature Communications contaron con la participación de estas instituciones: Instituto de Investigaciones Biotecnológicas de la UNSAM y del CONICET; Escuela de Bio y Nanotecnologías (EByN) de la UNSAM; Laboratorio Pablo Cassará; Fundación Pablo Cassará; Department of Entomology, College of Agriculture and Life Sciences, Fralin Life Science Institute, Virginia Polytechnic Institute and State University; Centro de Medicina Comparada, ICiVet – Litoral, Universidad Nacional del Litoral – CONICET; Servicio Virosis Respiratorias, Laboratorio de Referencia de Influenza, SARS-CoV-2 y otros Virus Respiratorios, Centro Nacional de Influenza de OPS/OMS, Departamento de Virología, Instituto Nacional de Enfermedades Infecciosas – ANLIS “Dr. Carlos G. Malbrán”; Instituto de Investigaciones Biomédicas en Retrovirus y SIDA, INBIRS – CONICET, Facultad de Medicina UBA; Center for Emerging, Zoonotic, and Arthropod-borne Pathogens, Virginia Polytechnic Institute and State University.
Además hay que sumar a la Agencia I+D+i y al Ministerio de Ciencia de la Nación, que desde 2020 co-financiaron el desarrollo junto con el Laboratorio Cassará.




