Hallan células inmunes en la nariz que podrían generar un avance revolucionario en el desarrollo de vacunas
* Este contenido fue producido por expertos del Instituto Weizmann de Ciencias, uno de los centros más importantes del mundo de investigación básica multidisciplinaria en el campo de las ciencias naturales y exactas, situado en la ciudad de Rejovot, Israel.
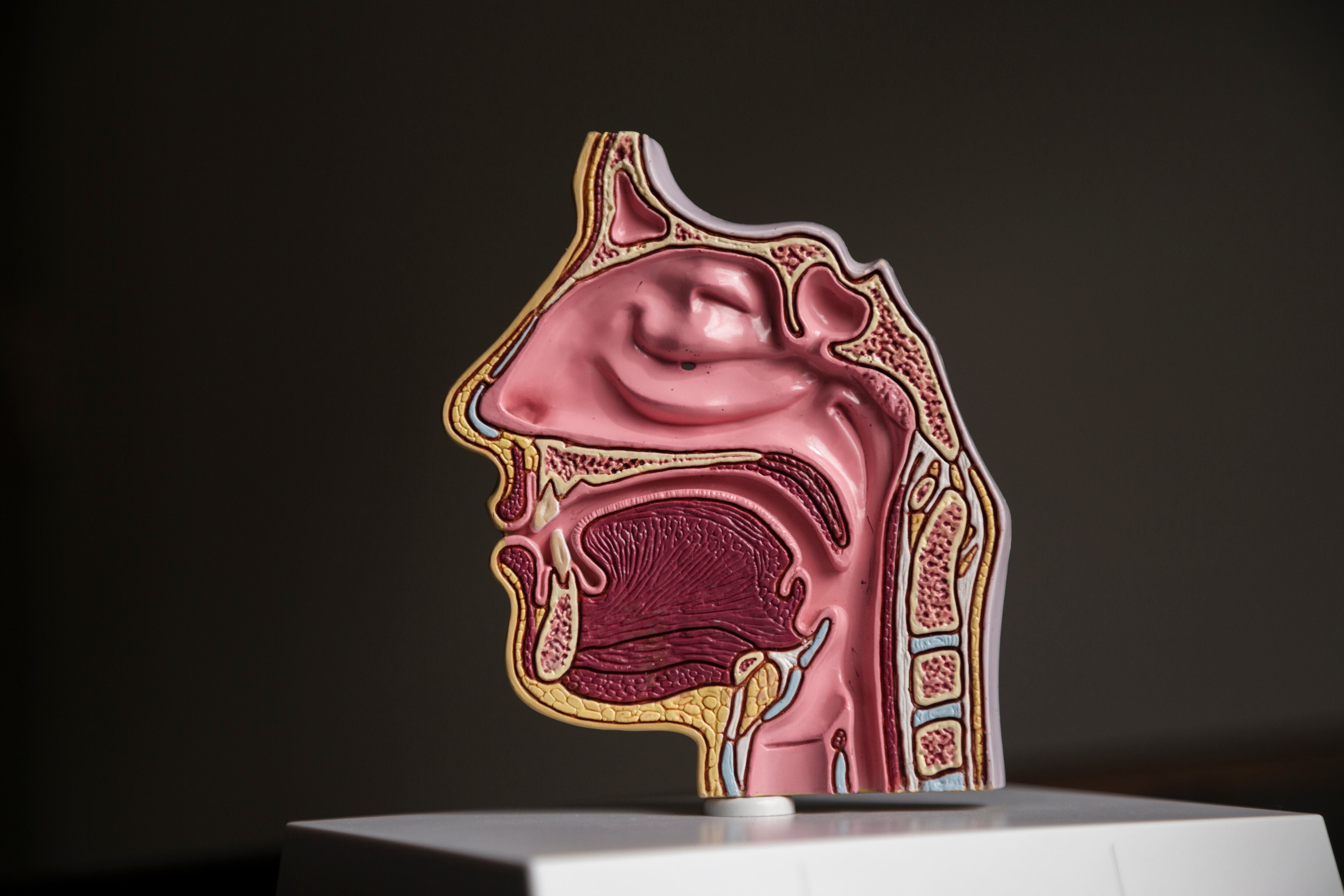
La nariz es una de las principales vías de acceso a nuestro cuerpo: el aire que respiramos, los aromas que olemos y los microbios que nos enferman. En su camino hacia adentro, el aire pasa por los cornetes nasales, las placas óseas largas, estrechas y curvadas que parecen una concha y sobresalen hacia el conducto respiratorio. Los cornetes están cubiertos por un tipo de tejido único que secreta moco y contiene muchas ramas de células nerviosas que son responsables de nuestro sentido del olfato. La estructura y función de los cornetes permite que el aire se caliente y absorba humedad antes de llegar a los pulmones.
Los cornetes nasales no solo son el principal punto de entrada de patógenos a las vías respiratorias, sino que también tienen un punto débil importante: como están situados tan cerca del cerebro, no son accesibles a los anticuerpos que nuestro sistema inmunitario envía a través del torrente sanguíneo durante una infección de las vías respiratorias superiores.
¿Cómo podemos, entonces, estar relativamente protegidos de los microbios invasores y no estar constantemente enfermos? En un nuevo estudio publicado hoy en Nature , investigadores del Instituto Weizmann de Ciencias descubrieron que las células secretoras de anticuerpos migran a los cornetes nasales siempre que estamos enfermos o nos vacunan, y desde allí secretan anticuerpos localmente en la cavidad nasal.

Este descubrimiento podría allanar el camino para vacunas nasales más eficaces y nuevos tratamientos para trastornos del sistema nervioso, alergias y enfermedades autoinmunes.
Durante la pandemia de coronavirus, cuando el virus se estaba propagando por todo el mundo, millones de personas siguieron de cerca el desarrollo de una vacuna contra la COVID que pudiera administrarse en forma de aerosol nasal en lugar de una inyección. La idea no era descabellada; después de todo, ya existen vacunas contra la gripe y otras muchas vacunas en forma de aerosol nasal, que contienen virus vivos, pero debilitados, que generan una protección local en los cornetes nasales. Sin embargo, estas vacunas nasales no son efectivas en una sola dosis y deben ser seguidas por una dosis de refuerzo. Sin embargo, los científicos aún no comprenden completamente cómo funcionan estas vacunas nasales y por qué es necesario un refuerzo.
Para arrojar luz sobre el asunto, el profesor Ziv Shulman, del Departamento de Inmunología de Sistemas de Weizmann, y Jingjing Liu, estudiante de doctorado en su laboratorio, decidieron examinar cómo los órganos del sistema inmunitario situados cerca de la nariz y la garganta responden a las vacunas nasales. En los seres humanos, estos órganos incluyen las amígdalas y los adenoides, conocidos colectivamente como anillo linfático de Waldeyer o anillo amigdalino.
En este nuevo estudio, un equipo de investigadores, dirigido por Liu, utilizó técnicas avanzadas de imagenología para analizar la respuesta inmunitaria del cuerpo mediante la obtención de imágenes de órganos del sistema inmunitario completos e intactos de ratones, similares a los de los seres humanos.

Los investigadores descubrieron que cuando se administraba una vacuna nasal a ratones, se desencadenaba una respuesta inmunitaria focalizada por parte de las células B, las principales productoras de anticuerpos del sistema inmunitario. Estas células comienzan su recorrido como células B precursoras, algunas de las cuales tienen el potencial de identificar patógenos.
Los científicos observaron cómo las células situadas cerca del tejido mucoso que cubre la cavidad nasal identificaban las moléculas de la vacuna y comenzaban a dividirse y diferenciarse rápidamente. Este proceso de diferenciación puede considerarse como una especie de curso de especialización biológica, que termina cuando se convierten en células que secretan anticuerpos específicos contra el patógeno o se convierten en células de memoria. Las células de memoria se almacenan durante largos períodos de tiempo en caso de una futura infección.
Las células B pueden secretar cinco tipos de anticuerpos. Los investigadores descubrieron que, en respuesta a una vacuna, las células B cercanas a la cavidad nasal cambian la identidad del anticuerpo que producen y comienzan a secretar anticuerpos que actúan como “guardianes” que se especializan en pasar del tejido mucoso interno a la cavidad nasal. La siguiente etapa es que las células B se muevan desde su ubicación cercana a la cavidad nasal a pequeños “campos de entrenamiento”, conocidos como centros germinales, que se encuentran en los órganos del sistema inmunológico en esa parte del cuerpo.

Una vez allí, se someten a un “entrenamiento” que incluye cambios en su composición genética y un meticuloso proceso de selección para garantizar la supervivencia solo de aquellas células B que producen los anticuerpos vinculados de manera efectiva al patógeno al que se dirige la vacuna.
En este proceso de preparación, las células B reciben la ayuda de un tipo de célula T, que incluso influye en la decisión de qué células sobrevivirán al final, pero los investigadores descubrieron que no hay suficientes células T de este tipo en los órganos del sistema inmunitario de esa parte del cuerpo para crear una respuesta inmunitaria eficaz. “El hecho de que tenga que haber una migración de células T a esa zona explica por qué una dosis de vacuna nasal no es suficiente y se necesita una dosis de refuerzo”, explica Shulman.
“Solo después de la segunda dosis se producen suficientes células T necesarias para convertir a las células B en productoras eficaces de anticuerpos y en células de memoria”.
Los investigadores creen que la escasez de células T está diseñada para evitar la hipersensibilidad a cantidades inofensivas de objetos extraños en el aire. “Es posible que este mecanismo falle cuando las personas desarrollan alergias y diversas enfermedades autoinmunes, por lo que comprenderlo podría ayudar a desarrollar nuevos tratamientos para estas afecciones”, agrega Shulman.
Una búsqueda del tesoro en materia de inmunización
El descubrimiento de que el mecanismo inmunitario se activaba en respuesta a las vacunas fue solo el punto de partida de una búsqueda intensiva para determinar a dónde van las células secretoras de anticuerpos una vez completado el proceso de diferenciación. “Visualizamos una respuesta inmunitaria en los ganglios linfáticos nasales, pero ¿cómo se traduce en protección de las vías respiratorias?”, afirma Shulman.
“Nos sorprendió descubrir las células B en los cornetes nasales, tejido óseo que no se sabía que apoyara una respuesta inmunitaria mediada por anticuerpos. Esta reubicación en el tejido óseo es similar a lo que ocurre en la médula ósea, y es posible que este entorno de nicho tenga otras funciones más allá del mecanismo inmunitario que identificamos”.
Los nuevos hallazgos muestran que las células secretoras de anticuerpos se trasladan desde los ganglios linfáticos nasales a las glándulas productoras de moco en los cornetes nasales, justo debajo de sus capas externas de células, y que secretan sus anticuerpos en estas glándulas. Esta defensa inmunitaria compensa la incapacidad de los anticuerpos sanguíneos para llegar a esta puerta de entrada a través del torrente sanguíneo y es importante no solo en el contexto de virus y otras enfermedades: también protege el cerebro y las numerosas terminaciones nerviosas de esa parte del cuerpo, responsables de nuestro sentido del olfato.

Además de facilitar el diseño de vacunas, Shulman señala que esta investigación ha descubierto “un punto de entrada a un objetivo altamente fortificado: las células secretoras de anticuerpos que tienen acceso al sistema nervioso central”. En el futuro, podría ser posible aprovechar el acceso de las células secretoras de anticuerpos a los nervios olfativos para diseñar vacunas contra enfermedades neurológicas.
También participaron en el estudio la Dra. Liat Stoler-Barak, la Dra. Hadas Hezroni-Bravyi y el Dr. Adi Biram del Departamento de Inmunología de Sistemas de Weizmann; Sacha Lebon, la Dra. Natalia Davidzohn y el Dr. Moshe Biton del Departamento de Inmunología y Biología Regenerativa de Weizmann; la Dra. Merav Kedmi, Muriel Chemla y el Dr. David Pilzer del Departamento de Instalaciones Básicas de Ciencias de la Vida de Weizmann y el Centro Nacional de Medicina Personalizada Nancy y Stephen Grand Israel del Instituto Weizmann; y la Dra. Marina Cohen y el Dr. Ori Brenner del Departamento de Recursos Veterinarios de Weizmann.